Аммиак
|
Поделитесь страницей в Социальных сетях
|
|
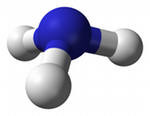 "АММИАК (от греч. hals ammoniakos - нашатырь), NH3, бесцветный газ с резким удушливым запахом; плотность 0,681 г/куб. см (-33,35 °С), tпл -77,7 °С, tкип -33,35 °С; при давлении 0,9 МПа сжижается при комнатной температуре. Хорошо растворим в воде; водный раствор - нашатырный спирт. Получают каталитическим синтезом из азота и водорода под давлением. Применяют в производстве азотной кислоты и удобрений (4/5 производимого аммиака), аммониевых солей, синильной кислоты, соды. Жидкий аммиак - хладагент, высококонцентрированное удобрение. Взрывоопасен. Токсичен. АММИАК (от греч. hals ammoniakos - амонова соль, нашатырь, который получали около храма бога Амона в Египте), NH3, бесцветный газ с резким запахом. Молекула имеет форму правильной пирамиды. Связи N-H полярны. Молярная масса 17 г/моль. Плотность 0,639 г/куб. дм. Температура кипения -33,35 °C, температура плавления -77,7 °C. Критическая температура 113 °C, критическое давление 11,425 кПа. Теплота испарения 23,27 кДж/моль, теплота плавления 5,86 кДж/моль. Получение. Впервые чистый аммиак был получен в 1774 Дж. Пристли. Промышленную технологию получения аммиака разработали и осуществили в 1913 немцы Ф. Габер и К. Бош, получившие за свои исследования Нобелевские премии. В промышленности аммиак получают в стальных колоннах синтеза, наполненных катализатором - пористым железом. Через колонну под давлением 30 МПа и при температуре 420-500 °C пропускают смесь азота и водорода."
Вас также могут заинтересовать
Аммиак водный (вода аммиачная) NH3-H2O- Применяется в сельском хозяйстве, как удобрение, в животноводстве для аммонизации кормов. Также вода аммиачная применяется как хладагент в холодильной технике.
Химическая формула - NH3, нитрид водорода.Молекулярная масса (по международным атомным массам 1985 г.) - 17,03. Плотность вещества - 0.6942 г/см3 При нормальных условиях - бесцветный газ с резким хар
Аммиак — базовое сырье для производства азотных удобрений. Предприятия Группы «Акрон» производят два типа аммиак а: безводный сжиженный аммиак и водный технический аммиак. Большая часть аммиака идет
Аммиак — базовое сырье для производства азотных удобрений. Предприятия Группы «Акрон» производят два типа аммиака: безводный сжиженный аммиак и водный технический аммиак. Большая часть аммиака идет на
Купить аммиак ГОСТ 9-92, марка А и Б Продажа аммиакак по России - прямые поставки с завода производителя. Изготовлен по ГОСТ 9-92. содержание аммиака - 25%. Оптовая фасовка в кубы или наливом в автоци
Внимание!
Информация по Аммиак предоставлена компанией-поставщиком Холод-Сервис, ООО. Для того, чтобы получить дополнительную информацию, узнать актуальную цену или условия постаки, нажмите ссылку «Отправить сообщение».
|






